English version at the end
É notável como os avanços tecnológicos dos últimos tempos facilitou a nossa vida e aumentou a rapidez das comunicações. Na ciência não poderia ser diferente! Os avanços tecnológicos facilitaram a troca e a difusão de ideias e principalmente, tornou determinadas tarefas extremamente mais fáceis!

O primeiro avanço que podemos destacar aqui é o processo de digitalização de artigos e publicações científicas. Enquanto que livros científicos há algumas décadas levavam muitos anos para serem escritos e publicados, atualmente com a facilidade dos computadores e da internet, um artigo científico pode ser concluído e publicado em poucos meses. Além disso, a evolução dos softwares estatísticos permitiu um enorme avanço e o surgimento de inúmeras análises estatísticas que ampliaram a nossa capacidade de avaliação dos dados e consequentemente de entendimento da natureza. Imagina ter que fazer as complexas análises multivariadas, tão importantes nos estudos de ecologia de comunidades, todas à mão?!?

O avanço tecnológico na ciência descortinou um novo horizonte para a pesquisa científica das ciências biológicas e é claro para a limnologia. Atingimos um novo patamar de estudos de alta complexidade, experimentais, de campo e de modelagem ecológica, deixando para trás os estudos que eram única e exclusivamente descritivos para propor hipóteses a cerca do funcionamento e estrutura dos ecossistemas, comunidades e populações.
Os avanços no que tange as análises de campo e laboratoriais não ficam para trás. Muitos equipamentos foram desenvolvidos para realizar medições e coleta de dados que antes levaríamos dias ou semanas para ficarem prontos. Entretanto, estes equipamentos são ferramentas que atendem a certos objetivos e precisamos conhecer sua forma básica de funcionamento para inclusive perceber possíveis erros nas medições ou resultados. Será que sabemos o princípio de medição de alguns equipamentos comuns nos trabalhos de campo em limnologia? Vamos ilustrar alguns!

Oxímetro
O oxigênio é um recurso necessário para a grande maioria dos seres vivos. Em ambientes aquáticos a difusão e a solubilidade do oxigênio são muito baixas tornando-o um fator limitante para os organismos ali viventes. Sua solubilidade decresce rapidamente com o aumento da temperatura e sua concentração é dependente dos seguintes fatores: fotossíntese, difusão, respiração e decomposição. Os dois primeiros aumentam a concentração de oxigênio dissolvido na água, os restantes a diminuem. A análise do oxigênio dissolvido é de suma importância para a caracterização e entendimento dos ambientas aquáticos, além de ser um indicativo de processos que possam estar ocorrendo dentro do sistema ecológico do corpo hídrico podendo ser usado até em estratégias de manejo e conservação.
A maioria dos oxímetros utilizados por limnólogos em campo é baseado no eletrodo de oxigênio desenvolvido por L. C. Clark. O equipamento é constituído por um eletrodo de platina (catodo) e por um de prata (anodo) imersos numa solução saturada de KCl. Este conjunto encontra-se montado num suporte de resina epóxido e é revestido com uma membrana de polietileno ou teflon, ajustada na extremidade do eletrodo por meio de um anel de borracha. O uso desta membrana impede o contato direto entre a amostra e o catodo, evitando assim a deposição de materiais que iriam afetar as características de resposta ao oxigênio.

A membrana é permeável a O2 e a outros gases (SH2 e SO2 são interferentes), os quais são postos em contato com o catodo (eletrodo de platina). Aplicando ao sistema uma voltagem conveniente, o oxigênio difundido para o catodo reduz-se enquanto que no anodo ocorre a formação de cloreto de prata, liberação de elétrons e formação de corrente. Nestas condições, a intensidade da corrente que flui no sistema é diretamente proporcional à quantidade de oxigênio que se difunde através da membrana, a qual por sua vez é proporcional à concentração de oxigênio dissolvido na amostra. Para obter uma resposta rápida por parte do eletrodo é necessário impedir o decréscimo da concentração de O2 localizado na zona da solução adjacente à extremidade do eletrodo. Para isso a solução é continuamente homogeneizada através da agitação do eletrodo.
Sem dúvidas o uso do oxímetro diminuiu e muito as dificuldades nas medições do oxigênio dissolvido, antes realizada pelo método de Winkler, além de fornecer os dados em tempo real. Mas é necessário atenção ao equipamento! A membrana que envolve o eletrodo deve ser trocada periodicamente e as medições devem ser sempre calibradas em função da salinidade do ambiente amostrado.
Condutivímetro e Salinômetro
A condutividade elétrica de uma solução é a capacidade desta em conduzir a corrente elétrica. Considerando-se que a capacidade de uma solução em conduzir a corrente elétrica é função da concentração dos íons presentes, é de se esperar que em soluções de maior concentração iônica, maior será a condutividade elétrica. Por outro lado, em águas muito puras ocorre fenômeno inverso: maior será a resistência e menor a condutividade.
A condutividade elétrica da água constitui uma das variáveis mais importantes em limnologia, visto que pode fornecer importantes informações tanto sobre o metabolismo do ecossistema aquático, como sobre fenômenos importantes que ocorrem na sua bacia de drenagem. Dentre as informações que podem ser fornecidas pelos valores de condutividade elétrica destacam-se a magnitude e variação da concentração iônica, detecção de fontes poluidoras e diferenças geoquímicas nos afluentes ou diferentes compartimentos e regiões de corpos hídricos.
A condutividade é geralmente determinada através do princípio de uma ponte de Wheatstone, que consiste em um dispositivo elétrico usado como medidor de resistências elétricas. Foi inventado por Samuel Hunter Christie em 1833, porém foi Charles Wheatstone quem ficou famoso com o invento, tendo-o descrito 10 anos mais tarde. O circuito é composto por uma fonte de tensão, um galvanômetro e uma rede de quatro resistores, sendo 3 destes conhecidos. Para determinar a resistência do resistor desconhecido os outros 3 são ajustados e balanceados até que a corrente elétrica no galvanômetro caia a zero.

A amostra irá funcionar com um resistor e a partir de uma célula com quatro eletrodos de níquel puro faz-se a medição da condutância da solução. Dois dos eletrodos são impulsionados com uma corrente e dois são usados para medir a tensão da água. A medida da queda de tensão quando a corrente é conduzida pela água é então convertida em um valor de condutividade em Siemens. Para converter este valor para um valor na condutividade Siemens por cm (mS / cm), a condutância é multiplicada pela condutividade da célula constante, que tem unidades de reciprocidade cm (cm-1).
Apesar do condutivímetro ser um equipamento normalmente mais robusto que o oxímetro, ele também merece nossa atenção e cuidado! Calibrações com soluções de condutividade conhecida são recomendadas periodicamente.
Em se tratando de salinidade, tida como a concentração de sais minerais dissolvidos na água, os principais íons responsáveis pela formação de sais em águas interiores são os cátions cálcio, magnésio, sódio, potássio e os ânios bicarbonato, cloreto e sulfato.
O equilíbrio de água nos organismos aquáticos está intimamente ligado ás concentrações de sais e outros solutos em seus tecidos corporais e no ambiente. Os tecidos de organismos de água doce têm normalmente concentrações de sais mais alta do que a água circundante. Estes seres são denominados hiperosmóticos e tendem a ganhar água do meio. Já seres marinhos que tem concentrações mais baixas de sais nos tecidos do que a água circundante tendem a perder água e são denominados hiposmóticos.
Os ambientes de água doce apresentam um conjunto de condições especializadas, pois a água tende a penetrar nos organismos, e este fenômeno deve ser contido. Assim, para muitos organismos aquáticos, a regulação da concentração fluida do corpo é um processo vital e, ás vezes, energeticamente dispendioso. A salinidade de um ambiente aquático pode ter uma influência importante sobre distribuição e a abundância dos organismos. Logo é um parâmetro de suma importância para o estudo dos ecossistemas aquáticos continentais.
O princípio de funcionamento para as medidas de salinidade é determinado automaticamente a partir das leituras de condutividade elétrica, de acordo com os algoritmos específicos que convertem os valores de condutância em quantidade de sais.
pHmetro
O pH em ambientes aquáticos é uma condição que exerce uma poderosa influência sobre a distribuição e abundância dos organismos. Os íons H+ em altas concentrações afetam as atividades da maioria das enzimas e trazem outras consequências geralmente negativas para os processos vitais. O protoplasma das células das raízes da maioria das plantas aquáticas é danificado como resultado direto da concentração de íons H+ ou OH–. O pH também desempenha um papel crucial na dissolução dos minerais das rochas e dos solos.
A determinação do pH é feita eletrometricamente com a utilização de um pHmetro. O sistema medidor consiste de um potenciômetro (aparelho medidor de diferença de potencial), um eletrodo de vidro, um eletrodo de referência e um sensor de compensação de temperatura. Geralmente, em aparelhos mais modernos um eletrodo de vidro combinado é o mais utilizado. As medições de pH são baseadas na equação de Nernst, que na prática correspondem a variação do potencial do eletrodo como resposta à variação do pH enquanto atividade do íon hidrogênio.
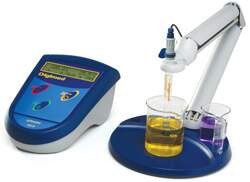
O eletrodo é composto por uma membrana seletiva localizada no bulbo de vidro que fica na extremidade inferior do eletrodo. Dentro do eletrodo encontramos uma solução de concentração fixa de ácido clorídrico (HCl) ou uma solução tamponada de cloreto (KCl, na maioria dos casos) em contato com o eletrodo de referência interno, normalmente constituído de prata revestida de cloreto de prata, que assegura um potencial constante na interface da superfície interna do sensor com o eletrólito. O silicato de sódio, maior constituinte do vidro, pode ser hidratado, formando um gel em sua superfície. Assim, se forma uma membrana que interage com os íons H+ e OH- da amostra e a diferença de carga em H+ de cada lado da membrana é suficiente para provocar um potencial. Essa diferença de potencial é então mensurada em milivolts e convertida para valores de pH de acordo com uma curva de calibração interna feita anteriormente. Lembre-se: sempre que for realizar um medição de pH é preciso fazer a calibração do aparelho com pelo menos dois pontos de referência (geralmente uma solução padrão de pH 4 e outra de pH 7).
O pHmetro talvez seja um dos aparelhos mais utilizados nas análises em limnologia e também aquele que mais gera preocupação ao limnólogos. Seu uso exige cuidados, pois seus eletrodos são bastante sensíveis, devem ser guardados em solução apropriada e necessitam de manutenção constante. A solução eletrolítica interna deve ser trocada com periodicidade e a integridade do bulbo de vidro deve ser verificada sempre antes do uso. Mas, sem dúvidas o pHmetro nos livrou de muitas horas que gastaríamos fazendo titulação de nossas amostras!

Além dos exemplos citados, muitos outros equipamentos facilitam nossa vida. Desde a coleta de campo, onde os dados são gerados, passando pelas análises de laboratório e estatísticas até a escrita das conclusões de nossos estudos. Que bom que eles existem! Podemos usar o tempo ganho com as novas tecnologias em mais tempo de estudo e na discussão de ideias. Entretanto, não sejamos somente “apertadores de botões”, um bom cientista precisa saber o mínimo por trás do funcionamento de qualquer equipamento até para poder interpretar e avaliar seus resultados. Parafraseando um professor de grande estima, não precisamos saber toda a mecânica do carro para maneja-lo, mas todo mundo tem que fazer auto-escola para dirigir. Algumas horas de estudo prévio sobre o funcionamento dos equipamentos e ferramentas utilizados na pesquisa podem fazer toda diferença no final!
………………………………………………………………………………………………………………………………………….
Technology applied to Limnology and what we need to know
It is remarkable how the technological advances of the last times have facilitated our life and increased the speed of communications. In science it could not have been different! The technological advances facilitated the exchange and diffusion of ideas, and especially, make some tasks much easier.
The first breakthrough we can highlight here is the process of digitizing articles and scientific publications. While scientific books a few decades ago took many years to be written and published, currently with a computer and internet facility, a scientific paper can be completed and published in a few months. In addition, the statistical software evolution has allowed a huge advance and the appearance of numerous statistical analyzes that have increased our capacity to evaluate the data and consequently to understand nature.
The technological advance in science promotes a new perspective for a scientific research in biological sciences and of course in limnology. We have reached a new level of high complexity studies leaving behind studies that are exclusively descriptive to propose hypotheses about the functioning and structure of ecosystems, communities and populations.
Many devices have been developed to perform measurements and data collection. Before, this could take many days or weeks of hard work. However, these equipments are tools that aim certain objectives and we need to know its basic form of operation to identify errors in measurements or results. Do we know the measuring principle of some common equipment in limnology? Let’s explain some!
Oximeter
Oxygen is a necessary resource for a large majority of organisms. In aquatic environments, oxygen diffusion and solubility are very low making it a limitation factor. Its solubility decreases rapidly with temperature increasing and its concentration is dependent on the following factors: photosynthesis, diffusion, respiration and decomposition. The first two increase a concentration of dissolved oxygen in the water, the rest decrease it. A dissolved oxygen analysis has a great importance for an aquatic environments characterization and understanding.
Most of the equipments used in field by limnologists is based on oxygen electrode developed by L. C. Clark. The equipment consists of a platinum electrode (cathode) and a silver electrode (anode) immersed in a saturated solution of KCl. This assembly is mounted on an epoxy resin support and is it coated with a polyethylene or teflon membrane. The use of this membrane prevents the direct contact between a sample and the cathode, thus avoiding a deposition of materials that could affect as oxygen response characteristics.
A membrane is permeable to O2 and other gases (SH2 and SO2 are interferents), which are brought into contact with the cathode (platinum electrode). Applying to the system an adequate voltage, there is a release of electrons and current formation. Under these conditions, the current intensity and flow are proportional to the amount of oxygen diffusing through the membrane, that in turn is proportional to the oxygen concentration dissolved in the sample.
Undoubtedly the use of the oximeter decreased and much the difficulties in the dissolved oxygen measurements. Before, the Winkler method was used. But attention to equipment is necessary! A membrane surrounding the electrode must be changed periodically and always before the measurements, the equipment have to be calibrated according to the water salinity.
Conductivity Meter and Salinometer
The electrical conductivity of a solution is its ability to conduct electric current. Considering that the capacity of a solution in conducting the electric current is a function of the concentration of the ions present, it is expected that in solutions of higher ionic concentration, greater the electrical conductivity.
The electrical conductivity of water is one of the most important variables in limnology since it can provide important information about the metabolism of the aquatic ecosystem and important phenomena that occur in its drainage basin. Among the information that can be provided by the electrical conductivity values are the magnitude and variation of the ionic concentration, detection of pollutant sources and geochemical differences in the tributaries, compartments and regions of water bodies.
Conductivity is generally determined by the principle of a Wheatstone bridge, which consists of an electrical device used as an electrical resistance meter. It was invented by Samuel Hunter Christie in 1833, but it was Charles Wheatstone who became famous with the invention, having described it 10 years later. The circuit consists of a voltage source, a galvanometer and a network of four resistors, three of which are known. To determine the resistance of the unknown resistor the other 3 are adjusted and balanced until the electric current in the galvanometer falls to zero.
The sample will work with a resistor and from a cell with four electrodes of pure nickel the conductance of the solution is measured. Two of the electrodes are driven with a current and two are used to measure the voltage of the water. The measurement of the voltage drop when the current is conducted by the water is then converted to a conductivity value at Siemens.
Although the conductivity meter is usually more robust than the oximeter, it also deserves our attention and care! Calibrations with solutions of known conductivity are recommended periodically.
In the case of salinity, considered as the concentration of dissolved salts in water, the main ions responsible for the formation of salts in inland waters are calcium, magnesium, sodium, potassium, bicarbonate, chloride and sulfate.
The water balance in aquatic organisms is closely linked to the concentrations of salts in their body tissues and in the environment. The tissues of freshwater organisms usually have higher salt concentrations than the surrounding water. These organisms are called hyperosmotic and tend to gain water.
Freshwater environments present a set of specialized conditions, as water tends to penetrate organisms, and this phenomenon must be contained. Thus, for many aquatic organisms, regulating the body’s fluid concentration is a vital and, sometimes, energy-consuming process. The salinity of an aquatic environment can have a major influence on distribution and abundance of organisms. It is therefore a very important parameter for the study of continental aquatic ecosystems.
The operating principle for salinity measurements is automatically determined from the electrical conductivity readings, according to the specific algorithms that convert the conductance values to the quantity of salts.
pHmeter
pH in aquatic environments is a condition that exerts a powerful influence on the distribution and abundance of organisms. H+ ions at high concentrations affect the activities of most enzymes and have other generally negative consequences for vital processes. The root cells protoplasm of most aquatic plants is damaged as a direct result of the concentration of H+ or OH- ions. pH also plays a crucial role in the dissolution of minerals from rocks and soils.
pH is determined electrometrically using a pHmeter. The meter system consists of a potentiometer (potential difference meter), a glass electrode, a reference electrode, and a temperature compensation sensor. Generally, in modern equipments a combined glass electrode is the most commonly used. The pH measurements are based on the Nernst equation, which in practice correspond to the variation of the electrode potential as a response to pH variation as a hydrogen ion activity.
The electrode is composed of a selective membrane located in the glass bulb at the lower end of the electrode. Within the electrode we find a fixed solution of hydrochloric acid (HCl) or a buffered chloride solution (KCl, in most cases) in contact with the internal reference electrode, which ensures a constant potential at the interface of the sensor’s internal surface with the electrolyte. Sodium silicate, the largest constituent of glass, can be hydrated, forming a gel on its surface. Thus, a membrane interacting with the H+ and OH- ions of the sample is formed and the difference in charge on H + on each side of the membrane is sufficient to cause a potential. This potential difference is then measured in millivolts and converted to pH values according to an internal calibration curve previously made. Remember: whenever you are performing a pH measurement you must calibrate the instrument with at least two reference points (usually a standard solution of pH 4 and one of pH 7).
The pH meter is perhaps one of the most used devices in limnology analysis and also the one that most generates concern to the limnologists. Its use requires care, its electrodes are very fragile, must be stored in appropriate solution and require constant maintenance. The internal electrolytic solution must be changed periodically and the integrity of the glass bulb must be checked before use. But without doubt the pH meter released us from many hours we would spend titling our samples!
In addition to the examples cited, many other equipment makes our life easier. From field collection, where data are generated, through laboratory and statistical analyzes to the writing of the conclusions of our studies. How good they are! We can use the time gained with the new technologies in more study time and in the discussion of ideas. However, we are not just “button pushers”. A good scientist needs to know the minimum behind the operation of any equipment until in order to interpret and evaluate its results. Some hours of previous study about the operation of the equipment and tools used in the research can make all the difference in the end!





![[Mulher e Ciência] Teriam sido os primeiros ecólogos mulheres?](https://limnonews.biologia.ufrj.br/wp-content/uploads/2021/03/image-350x250.webp)
